El electrón desapareado no interacciona con el ![]() (
(![]() );
se deslocaliza preferentemente sobre el grupo amino y en las posiciones 3 y 5 del anillo
aromático; la constante de acoplamiento sobre los metilos del terc-butilo es nula ó casi nula
y no se observa su estructura hiperfina (19 líneas equidistantes) sobre el espectro.
);
se deslocaliza preferentemente sobre el grupo amino y en las posiciones 3 y 5 del anillo
aromático; la constante de acoplamiento sobre los metilos del terc-butilo es nula ó casi nula
y no se observa su estructura hiperfina (19 líneas equidistantes) sobre el espectro.

Número máximo de líneas (Ec. (9)): N = 3 ![]() 3
3 ![]() 3 = 27 líneas.
3 = 27 líneas.
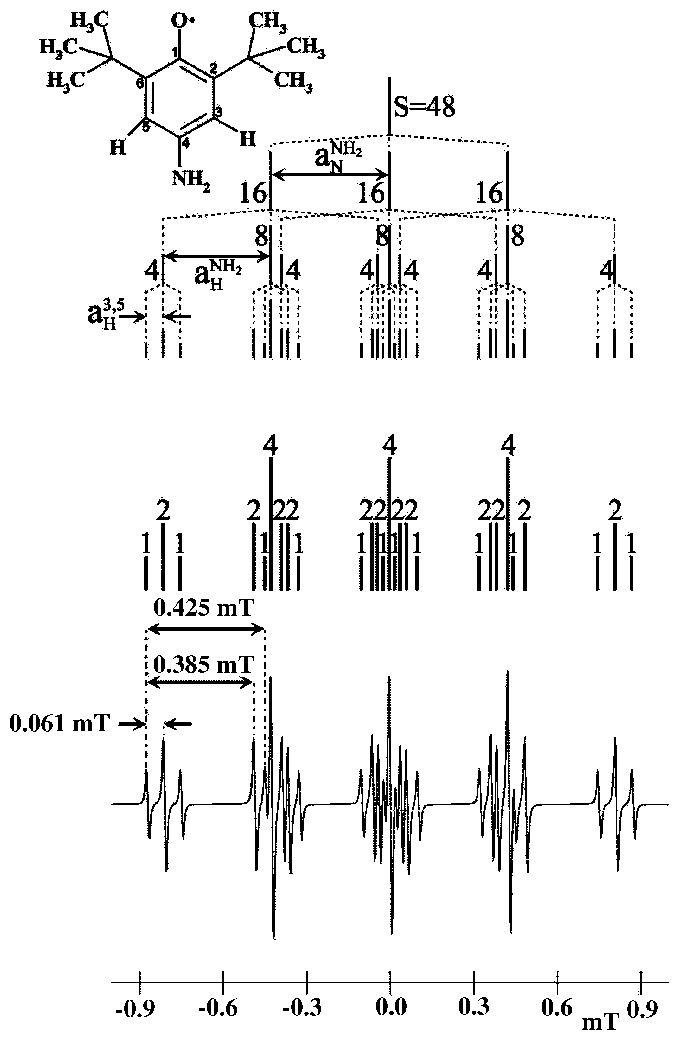
Se tienen tres constantes de acoplamiento, siendo muy próximas las dos mayores y dando lugar a un entrecruzamiento en las líneas correspondientes a estos tripletes; se observa claramente el triplete debido al acoplamiento del electrón con el N, líneas 6, 14 y 22.
Constantes de acoplamiento:
![]() = 0.061 mT (triplete, 1:2:1) .Entre la 1
= 0.061 mT (triplete, 1:2:1) .Entre la 1![]() y la 2
y la 2![]() .
.
![]() = 0.385 mT (triplete, 1:2:1). Entre la 1
= 0.385 mT (triplete, 1:2:1). Entre la 1![]() y la 4
y la 4![]() .
.
![]() = 0.425 mT (triplete, 1:1:1). Entre la 1
= 0.425 mT (triplete, 1:1:1). Entre la 1![]() y la 5
y la 5![]() .
.
Longitud del espectro (Ec. (8)):
L = 0.061 ![]() 2 + 0.385
2 + 0.385 ![]() 2 + 0.425
2 + 0.425 ![]() 2 = 1.742 mT.
2 = 1.742 mT.
Procede como en los radicales anteriores comparando tus valores con los dados; mide su longitud experimental.
Reconstrucción: se indica en la parte superior de la Fig. 28. Los números sobre las líneas indican sus intensidades relativas.
Este radical se presentan como un ejemplos resueltos (Fig. 28), que debes intentar comprender. A pesar de conocer el valor de sus constantes, entra en el simulador, mide las constantes y la longitud del espectro experimental. Introduce los datos y haz coincidir ambos espectros.
NOTA: No es posible asignar las constantes de los protones. Para su asignación existen distintos procedimientos:
 |
Los nueve espectros que se incluyen a continuación (subsecciones 8.2.2 a 8.2.11) están sin resolver. Tienen 2, 3 o 4 grupos de núcleos equivalentes con distinto valor de I. Fíjate detenidamente en la estructura de las moléculas para determinar el número de constantes de acoplamiento y los núcleos que origina desdoblamientos hiperfinos con el electrón desapareado. Asigna si es posible el orden de las constantes de acoplamiento. Para la interpretación procede como en la sección 8.1.2. Si lo necesitas utiliza la longitud del espectro experimental como un dato que te puede permitir calcular la última constante de acoplamiento usando la Ec. (8). Imprime el espectro experimental y los datos usados en la simulación.